Ingredientes ativos: tansulosina
Lura 0,4 mg cápsulas de liberação modificada
Indicações Por que o Lura é usado? Para que serve?
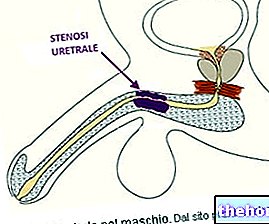
Lura contém a substância ativa cloridrato de tansulosina, que pertence à categoria de medicamentos denominados antagonistas dos recetores adrenérgicos alfa1, que reduzem a tensão dos músculos da próstata e da uretra ao facilitar a passagem e eliminação da urina.
Lura é utilizado em homens para tratar os sintomas do trato urinário inferior associados ao aumento da próstata (hiperplasia benigna da próstata).
Contra-indicações Quando Lura não deve ser usado
Não leve Lura
- se tem alergia à substância ativa ou a qualquer outro componente deste medicamento (listados na secção 6). A hipersensibilidade também se manifesta por inchaço local súbito das partes moles do corpo (por exemplo, garganta ou língua), dificuldade em respirar, por vezes acompanhada de comichão (angioedema).
- se tem problemas hepáticos graves (insuficiência hepática grave);
- se alguma vez teve problemas para baixar a tensão arterial ao se sentar ou deitar (hipotensão ortostática).
Precauções de uso O que você precisa saber antes de tomar Lura
Fale com o seu médico ou farmacêutico antes de tomar Lura.
- Tal como acontece com outros medicamentos deste tipo, em casos especiais com Lura pode ter uma redução da sua pressão arterial e raramente pode desmaiar. Aos primeiros sinais de tensão arterial baixa (hipotensão ortostática), como tonturas e fraqueza, deve sentar-se ou deitar-se até que os sintomas desapareçam.
- Antes de iniciar o tratamento com Lura, o seu médico terá de excluir a presença de outras doenças que podem causar os mesmos sintomas que o aumento da próstata (hiperplasia benigna da próstata) por meio de testes específicos.
- Se tiver problemas renais graves, o seu médico terá especial cuidado porque o medicamento não foi estudado nestas pessoas.
- Se tiver de ser submetido a cirurgia ocular para turvação do cristalino (catarata), informe o seu médico quem irá operar se você tomou ou está tomando Lura, pois tomar o medicamento pode aumentar as complicações cirúrgicas durante e após a cirurgia. O seu médico pode tomar as precauções adequadas em relação ao medicamento. Pergunte ao seu médico se você precisa adiar ou interromper temporariamente o tratamento antes de se submeter a uma cirurgia ocular.
- É possível que resíduos do comprimido sejam encontrados nas fezes.
Crianças e adolescentes
Lura não é adequado para crianças. A segurança e eficácia de Lura em crianças menores de 18 anos não foram estabelecidas
Interações Quais drogas ou alimentos podem modificar o efeito de Lura
Informe o seu médico ou farmacêutico se estiver a tomar ou tiver tomado recentemente, ou se vier a tomar outros medicamentos. Em particular, tenha cuidado se estiver tomando algum dos seguintes medicamentos:
- cimetidina (um medicamento para tratar o ácido do estômago)
- furosemida (diurético) Diclofenaco (para inflamação e dor) e varfarina (para tornar o sangue mais fino), pois podem aumentar a taxa de eliminação de Lura.
- cetoconazol (para o tratamento de infecções fúngicas) ou paroxetina (para depressão), pois podem aumentar o efeito de Lura.
- outros medicamentos pertencentes à mesma classe (antagonistas dos adrenoceptores alfa1), pois podem causar uma queda da pressão arterial.
Avisos É importante saber que:
Gravidez, amamentação e fertilidade
Lura não é adequado para pacientes do sexo feminino.
Ejaculação anormal (distúrbios de ejaculação) foi relatada no homem. Isso significa que o fluido seminal não sai do corpo pela uretra, mas entra na bexiga (ejaculação retrógrada) ou que o volume da ejaculação está reduzido ou ausente (falha na ejaculação).
Condução e utilização de máquinas
Pode ocorrer tontura após tomar Lura; nesse caso, você não deve se envolver em atividades que requeiram atenção.
Dose, método e tempo de administração Como usar Lura: Posologia
Tome este medicamento sempre de acordo com as indicações do seu médico ou farmacêutico. Em caso de dúvida, consulte o seu médico ou farmacêutico. A dose recomendada é de uma cápsula por dia para ser tomada após o café da manhã ou na primeira refeição do dia.
A cápsula deve ser engolida inteira e não deve ser esmagada ou mastigada, pois isso pode interferir na liberação modificada do ingrediente ativo.
Uso em crianças e adolescentes
Lura não é indicado para crianças e adolescentes com menos de 18 anos de idade.
Se você se esquecer de tomar Lura
Não tome uma dose a dobrar para compensar uma cápsula esquecida.
Caso ainda tenha dúvidas sobre a utilização deste medicamento, fale com o seu médico ou farmacêutico.
Overdose O que fazer se você tiver tomado muito Lura
Se você tomou mais Lura do que deveria, você pode ter quedas graves na sua pressão arterial, que foram observadas em diferentes níveis de sobredosagem.
Em caso de ingestão acidental / ingestão de uma dose excessiva de Lura, avise o seu médico imediatamente ou dirija-se ao hospital mais próximo.
Efeitos colaterais Quais são os efeitos colaterais de Lura
Como todos os medicamentos, este medicamento pode causar efeitos colaterais, embora nem todas as pessoas os tenham.
Os seguintes efeitos colaterais foram observados:
Efeitos colaterais comuns (podem afetar até 1 em 10 pessoas)
- tontura
- distúrbios de ejaculação
Efeitos colaterais incomuns (podem afetar até 1 em 100 pessoas)
- dor de cabeça (dor de cabeça)
- batimento cardíaco perceptível e frequente (palpitações)
- diminuição da pressão arterial ao mudar de sentar ou deitar para ficar em pé (hipotensão ortostática)
- nariz escorrendo e entupido (rinite)
- prisão de ventre, diarreia, náusea, vômito
- erupção cutânea, coceira, urticária
- fraqueza (astenia)
Efeitos colaterais raros (podem afetar até 1 em 1000 pessoas)
desmaio (síncope)
inchaço repentino das partes moles do corpo (por exemplo, pescoço e língua), dificuldade em respirar com ou sem coceira e vermelhidão da pele (angioedema)
Efeitos colaterais muito raros (podem afetar até 1 em 10.000 pessoas)
- erupção cutânea, inflamação, formação de bolhas na pele e / ou lábios, olhos, boca, narinas ou genitais (síndrome de Steven-Johnson)
- ereção peniana prolongada e dolorosa (priapismo)
Efeitos indesejáveis com frequência desconhecida (a frequência não pode ser estimada a partir dos dados disponíveis):
- visão turva, deficiência visual
- sangramento nasal (epistaxe)
- boca seca
- erupções cutâneas graves (eritema multiforme, dermatite esfoliativa)
- distúrbio de ejaculação, fluido seminal na bexiga (ejaculação retrógrada), falha de ejaculação.
- ritmo cardíaco anormal (fibrilação atrial, arritmia, taquicardia)
- dificuldade em respirar (dispneia).
Complicações cirúrgicas (síndrome da pupila pequena, conhecida como "Síndrome da íris em bandeira intraoperatória" - IFIS foram observadas e associadas ao tratamento com Lura durante a cirurgia ocular devido à opacidade do cristalino (catarata). E precauções ").
Relatório de efeitos colaterais
Se tiver quaisquer efeitos secundários, fale com o seu médico ou farmacêutico, incluindo quaisquer efeitos secundários possíveis não mencionados neste folheto. Você também pode relatar os efeitos colaterais diretamente através do sistema nacional de notificação em www.agenziafarmaco.it/it/responsabili Ao relatar os efeitos colaterais, você pode ajudar a fornecer mais informações sobre a segurança deste medicamento.
Expiração e retenção
Mantenha este medicamento fora da vista e do alcance das crianças.
Armazenar a uma temperatura não superior a 30 ° C.
Não utilize este medicamento após o prazo de validade impresso na embalagem exterior após o "prazo de validade". A data de validade refere-se ao último dia desse mês.
Não deite quaisquer medicamentos na canalização ou no lixo doméstico. Pergunte ao seu farmacêutico como deitar fora os medicamentos que já não utiliza. Isto ajudará a proteger o ambiente.
Outra informação
O que Lura contém
A substância ativa é o cloridrato de tansulosina: 1 cápsula contém 0,4 mg de cloridrato de tansulosina.
Os outros componentes são: celulose microcristalina, ácido metacrílico - copolímero de acrilato de etilo (1: 1), polissorbato 80, laurilsulfato de sódio, triacetina, talco, estearato de cálcio. A cápsula dura consiste em: gelatina, dióxido de titânio (E 171), índigo carmim (E 132), óxido de ferro amarelo (E 172), óxido de ferro vermelho (E 172), óxido de ferro preto (E 172).
Descrição da aparência de Lura e conteúdo da embalagem
Cápsula de liberação modificada, dura - Caixa com 20 cápsulas em embalagens de blister.
Folheto Informativo Fonte: AIFA (Agência Italiana de Medicamentos). Conteúdo publicado em janeiro de 2016. As informações apresentadas podem não estar atualizadas.
Para ter acesso à versão mais atualizada, é aconselhável acessar o site da AIFA (Agência Italiana de Medicamentos). Isenção de responsabilidade e informações úteis.
01.0 NOME DO MEDICAMENTO
CÁPSULAS DE LIBERAÇÃO MODIFICADA LURA 0.4 MG
02.0 COMPOSIÇÃO QUALITATIVA E QUANTITATIVA
Cada cápsula de liberação modificada contém 0,4 mg de cloridrato de tansulosina como ingrediente ativo.
Excipientes: para a lista completa de excipientes, ver secção 6.1.
03.0 FORMA FARMACÊUTICA
Cápsula de liberação modificada, dura
04.0 INFORMAÇÕES CLÍNICAS
04.1 Indicações terapêuticas
Sintomas do trato urinário inferior (STUI) associados à hiperplasia benigna da próstata (HPB).
04.2 Posologia e método de administração
Uso oral
Uma cápsula por dia para tomar após o pequeno almoço ou após a primeira refeição do dia. A cápsula deve ser engolida inteira.
As cápsulas não devem ser esmagadas ou mastigadas, pois isso pode interferir na liberação modificada do ingrediente ativo. Em caso de insuficiência renal, não é necessário ajuste da dose. No caso de insuficiência hepática ligeira a moderada, não é necessário ajuste da dose (ver também secção 4.3 Contra-indicações).
População pediátrica
Não há indicação de uso específico de LURA em crianças. A segurança e eficácia da tansulosina em crianças
04.3 Contra-indicações
Hipersensibilidade ao cloridrato de tansulosina, incluindo angioedema induzido por drogas ou a qualquer um dos excipientes.
História de hipotensão ortostática.
Insuficiência hepática grave.
04.4 Advertências especiais e precauções adequadas de uso
Tal como acontece com outros antagonistas dos adrenoceptores alfa 1, pode ocorrer uma redução da pressão arterial em casos especiais durante o tratamento com LURA, o que raramente pode levar à síncope. Aos primeiros sinais de hipotensão ortostática (tonturas, fraqueza), o paciente deve sentar-se ou deitar-se até que os sintomas desapareçam.
Antes de iniciar a terapia com LURA, o paciente deve ser avaliado quanto à presença de outras condições que podem causar os mesmos sintomas da hiperplasia benigna da próstata.
O exame retal e, se necessário, a determinação do antígeno específico da próstata (PSA) devem ser realizados antes do início do tratamento e, posteriormente, em intervalos regulares. O tratamento de doentes com compromisso renal grave (depuração da creatinina inferior a 10 ml / min) deve ser considerado com precaução, uma vez que o medicamento não foi estudado nestes indivíduos. Durante a cirurgia de catarata, alguns pacientes, previamente tratados ou tratados com medicamentos contendo tansulosina, experimentaram a IFIS "Síndrome da íris flexível intraoperatória" conhecida como íris flexível. O aparecimento desta síndrome pode aumentar as complicações cirúrgicas durante e após a cirurgia, portanto, é recomendado não iniciar o tratamento com tansulosina em pacientes que aguardam cirurgia de catarata.
Experiências anedóticas mostraram que interromper o tratamento com tansulosina 1 ou 2 semanas antes da cirurgia pode ajudar. No entanto, o benefício decorrente da suspensão e o período de interrupção necessário ainda não foram estabelecidos. O IFIS também foi encontrado em pacientes que interromperam a tansulosina por um período mais longo antes da cirurgia de catarata.
Na fase de avaliação pré-operatória, o médico deve investigar se o paciente pretendido para cirurgia está ou esteve em tratamento com tansulosina, a fim de garantir medidas adequadas para o manejo do IFIS durante a cirurgia.
O cloridrato de tansulosina não deve ser administrado em combinação com inibidores fortes do CYP3A4 em pacientes com um fenótipo de metabolização deficiente do CYP2D6.
O cloridrato de tansulosina deve ser usado com precaução em combinação com inibidores fortes e moderados do CYP3A4 (ver secção 4.5).
É possível que resíduos do comprimido sejam encontrados nas fezes.
04.5 Interações com outros medicamentos e outras formas de interação
Os estudos de interação foram realizados apenas em adultos.
Não foram observadas interações quando a tansulosina foi administrada concomitantemente com atenolol, enalapril ou nifedipina ou teofilina.
O uso concomitante de cimetidina causa um aumento nos níveis plasmáticos de tansulosina, enquanto a furosemida os reduz; no entanto, os níveis de concentração plasmática de tansulosina estão dentro da faixa terapêutica e, portanto, nenhum ajuste de dosagem é necessário.
Em vitro diazepam, propranolol, triclormetiazida, clormadinona, amitriptilina, diclofenaco, glibenclamida, sinvastatina e varfarina não alteram a fração livre da tansulosina no plasma humano. A tansulosina não modifica a fração livre do diazepam, propranolol, triclormetiazida e clormadinona. Nos estudos em vitro com frações hepáticas microssomais (representativas do sistema enzimático de metabolização do fármaco ligado ao citocromo P450) com amitriptilina, salbutamol, glibenclamida e finasterida não foram mostradas interações ao nível do metabolismo hepático. No entanto, o diclofenaco e a varfarina podem aumentar a taxa de eliminação da tansulosina.
A administração concomitante de cloridrato de tansulosina e inibidores fortes do CYP3A4 pode levar ao aumento da exposição ao cloridrato de tansulosina. A administração concomitante com cetoconazol (um conhecido inibidor forte do CYP3A4) resultou num aumento da AUC e C do cloridrato de tansulosina por um fator de 2,8 e 2,2, respetivamente.
O cloridrato de tansulosina não deve ser administrado em combinação com inibidores fortes do CYP3A4 em pacientes com um fenótipo de metabolização deficiente do CYP2D6.
O cloridrato de tansulosina deve ser usado com cautela em combinação com inibidores fortes e moderados do CYP3A4.
A administração concomitante de cloridrato de tansulosina e paroxetina, um forte inibidor do CYP2D6, resultou num aumento da Cmax e da AUC da tansulosina por um fator de 1,3 e 1,6, respetivamente, mas estes aumentos não são considerados clinicamente relevantes. O uso concomitante de outros antagonistas dos receptores adrenérgicos alfa1 pode causar efeitos hipotensores.
04.6 Gravidez e lactação
Não é relevante, pois o LURA é para uso apenas em pacientes do sexo masculino.
Em estudos clínicos de curto e longo prazo com cloridrato de tansulosina foram observados distúrbios de ejaculação. Em estudos pós-autorização, foram relatados casos de distúrbios de ejaculação, ejaculação retrógrada e incapacidade de ejacular.
04.7 Efeitos sobre a capacidade de dirigir e usar máquinas
Não foram realizados estudos sobre a capacidade de conduzir e utilizar máquinas. No entanto, o paciente deve estar ciente da possibilidade de ocorrência de vertigem.
04.8 Efeitos indesejáveis
Durante a cirurgia de catarata, foi observada uma variante da síndrome da pupila pequena conhecida como "Síndrome da Íris Intraoperatória" (IFIS) associada à terapia com tansulosina durante o período de vigilância pós-comercialização (ver também o parágrafo 4.4).
Experiência pós-comercialização: Além dos eventos adversos listados acima, fibrilação atrial, arritmia, taquicardia e dispneia foram relatadas em associação com o uso de tansulosina. a frequência e o papel da tansulosina em causá-los não podem ser determinados com certeza.
04.9 Overdose
Sintomas
A sobredosagem com cloridrato de tansulosina pode causar efeitos hipotensores graves.
Efeitos hipotensivos graves foram observados em diferentes níveis de sobredosagem.
Tratamento
Em caso de hipotensão aguda após uma sobredosagem, devem ser tomadas medidas imediatas a nível cardiovascular. A pressão arterial e a frequência cardíaca podem ser restauradas ao normal fazendo o paciente deitar. Se isso não bastasse, expansores de volume e, se necessário, vasoconstritores podem ser usados. A função renal deve ser monitorada e medidas gerais de suporte aplicadas. A diálise é de pouca utilidade, pois a tansulosina se liga fortemente às proteínas plasmáticas. Algumas medidas, como o vômito, podem ser tomadas para evitar a absorção.
Em caso de ingestão de grandes doses, a lavagem gástrica pode ser útil e carvão ativado e um laxante osmótico, como sulfato de sódio, podem ser administrados.
05.0 PROPRIEDADES FARMACOLÓGICAS
05.1 Propriedades farmacodinâmicas
Grupo farmacoterapêutico: antagonista do adrenoceptor alfa1.
Código ATC: G04CA02 - Medicamentos para o tratamento exclusivo de doenças da próstata - Tansulosina.
Mecanismo de ação: a tansulosina liga-se seletiva e competitivamente aos adrenoceptores alfa1 pós-sinápticos, em particular os subtipos alfa1A e alfa1D, que causam relaxamento do músculo liso da próstata e da uretra.
Efeitos farmacodinâmicos: tansulosina 0,4 mg aumenta o fluxo urinário máximo. Alivia a obstrução relaxando o músculo liso da próstata e da uretra, melhorando assim os sintomas de micção. Também melhora os sintomas de enchimento, nos quais a instabilidade da bexiga desempenha um papel importante.
Esses efeitos sobre os sintomas de enchimento e esvaziamento são mantidos durante a terapia de longo prazo. A necessidade de cirurgia ou cateterismo é significativamente atrasada.
Os antagonistas dos receptores adrenérgicos alfa1 podem reduzir a pressão arterial, reduzindo a resistência periférica. Nenhuma redução clinicamente significativa da pressão arterial foi observada durante os ensaios clínicos com tansulosina.
População pediátrica
Um estudo duplo-cego, randomizado, controlado por placebo, de variação de dose foi conduzido em crianças com bexiga neuropática. Um total de 161 crianças (com idades entre 2 e 16 anos) foram randomizados e tratados com 1 de 3 níveis de dose de tansulosina (baixo [0,001 a 0,002 mg / kg], médio [0,002 a 0,004 mg / kg] e alto [0,004 a 0,008 mg / kg]) ou com placebo. O desfecho primário foi o número de pacientes cujo ponto de fuga da pressão do detrusor (pressão do ponto de vazamento do detrusor, LPP) diminuiu até a estabilização da hidronefrose e do hidroureter e alteração nos volumes urinários obtidos no cateterismo e no número de vazamentos de urina durante o cateterismo, conforme registrado nos diários de cateterismo. Não houve diferença significativa entre o grupo de placebo e qualquer um dos 3 grupos de tansulosina para os desfechos primários ou secundários.Nenhuma resposta à dose foi observada para qualquer nível de dose.
05.2 Propriedades farmacocinéticas
Absorção
A tansulosina é absorvida pelo intestino e está quase totalmente biodisponível.
A absorção do cloridrato de tansulosina é reduzida tomando-o próximo às refeições.
A absorção uniforme pode ser alcançada se o paciente sempre tomar o produto após a mesma refeição.
A tansulosina exibe cinética linear.
Após uma dose única de tansulosina com a alimentação, os níveis plasmáticos de tansulosina atingem o pico em aproximadamente 6 horas e, em condições de estado estacionário, que são atingidos após 5 dias de tratamento, a Cmax é aproximadamente 2/3 superior à alcançada após uma dose única.
Isso foi observado em pacientes idosos e é razoável esperar o mesmo em pacientes mais jovens.
Existe uma variação individual considerável nos níveis plasmáticos após a dosagem única e repetida.
Distribuição
Em humanos, a tansulosina liga-se às proteínas plasmáticas em aproximadamente 99% e o volume de distribuição é baixo (aproximadamente 0,2 l / kg).
Biotransformação
A tansulosina tem um efeito pobre de primeira passagem, pois é metabolizada lentamente.
A tansulosina está presente no plasma principalmente na forma de ingrediente ativo inalterado.
É metabolizado no fígado.
Praticamente nenhuma indução do sistema enzimático microssomal do fígado causada pela tansulosina foi observada no rato. Os resultados in vitro sugerem que o CYP3A4 e também o CYP2D6 estão envolvidos no metabolismo, com possíveis contribuições menores para o metabolismo do cloridrato de tansulosina por outras isoenzimas do CYP. A inibição das enzimas que metabolizam o medicamento CYP3A4 e CYP2D6 pode levar a um aumento da exposição ao cloridrato de tansulosina (ver secções 4.4 e 4.5).
Nenhum dos metabólitos é mais ativo do que o produto original.
Eliminação
A tansulosina e seus metabólitos são eliminados principalmente na urina e aproximadamente 9% do medicamento ingerido é eliminado na forma inalterada.
Após uma dose única de 0,4 mg de tansulosina em condições de alimentação e estado estacionário, as semividas de eliminação foram medidas às 10 e 13 horas, respectivamente.
05.3 Dados de segurança pré-clínica
Estudos de toxicidade de dose única e repetida foram realizados em camundongos, ratos e cães. Estudos de reprodução em ratos, estudos de carcinogenicidade em camundongos e ratos, estudos de genotoxicidade também foram considerados. em vitro E na Vivo.
O perfil toxicológico geral, determinado com as doses mais elevadas de tansulosina, é consistente com a atividade farmacológica conhecida dos medicamentos antagonistas do adrenoreceptor alfa1. Em cães, em doses muito elevadas, o eletrocardiograma é alterado.Esta resposta não é considerada clinicamente relevante.
A tansulosina não apresentou propriedades genotóxicas relevantes.
Foi relatado um aumento na incidência de alterações proliferativas no úbere de ratas e camundongos. Esses achados, que provavelmente são mediados por hiperprolactinemia e ocorrem apenas em altas doses, são considerados irrelevantes.
06.0 INFORMAÇÕES FARMACÊUTICAS
06.1 Excipientes
Celulose microcristalina, Copolímero de ácido metacrílico - etilacrilato (1: 1), Polissorbato 80, Laurilsulfato de sódio, Triacetina, Talco, Estearato de cálcio.
Cápsula dura: gelatina, dióxido de titânio (E 171), índigo carmim (E 132), óxido de ferro amarelo (E 172), óxido de ferro vermelho (E 172), óxido de ferro preto (E 172).
06.2 Incompatibilidade
Não é relevante.
06.3 Período de validade
2 anos.
06.4 Precauções especiais para armazenamento
Armazenar a uma temperatura não superior a 30 ° C.
06.5 Natureza da embalagem primária e conteúdo da embalagem
Blister de PVC / Al termossoldado em caixa de papelão litografado, 20 cápsulas.
06.6 Instruções de uso e manuseio
Sem instruções especiais.
O produto não utilizado e os resíduos derivados deste medicamento devem ser eliminados de acordo com os requisitos legais locais.
07.0 TITULAR DA AUTORIZAÇÃO DE INTRODUÇÃO NO MERCADO
ECUPHARMA S.r.l
Via Mazzini 20
20123 Milão
08.0 NÚMERO DE AUTORIZAÇÃO DE INTRODUÇÃO NO MERCADO
LURA
"0,4 MG CÁPSULAS DE LIBERAÇÃO MODIFICADA - 20 CÁPSULAS AIC N. 036943013
09.0 DATA DA PRIMEIRA AUTORIZAÇÃO OU RENOVAÇÃO DA AUTORIZAÇÃO
4 de julho de 2006
Abril de 2013